Se você já se perguntou sobre o impacto das análises clínicas e microbiologia na saúde humana, você não está sozinho. Estas disciplinas são pilares essenciais na prática médica, atuando na detecção e tratamento de doenças.
Neste guia completo, vamos explorar os fundamentos de cada uma dessas regras, suas aplicações e a importância de se especializar no campo das análises clínicas e microbiologia:
O que é Análises Clínicas e Microbiologia?
As análises clínicas são um componente essencial da medicina moderna, oferecendo um suporte crítico para o diagnóstico e tratamento de doenças. Elas envolvem a coleta, análise e interpretação de amostras biológicas, como sangue, urina, fezes e outros fluidos corporais. Esse processo permite a identificação de patologias, monitoramento de condições de saúde e a avaliação da eficácia das intervenções médicas. A capacidade de transformar dados biológicos em informações significativas é o que torna as análises clínicas um campo tão vital.
Além disso, a evolução tecnológica tem permitido que os métodos de análise se tornem cada vez mais precisos e rápidos, facilitando a identificação precoce de doenças e, consequentemente, melhorando as chances de tratamento. Equipamentos sofisticados e técnicas avançadas têm tornado os laboratórios de análises clínicas um ambiente de inovação, onde profissionais da saúde se dedicam a garantir que os resultados sejam confiáveis e relevantes para a tomada de decisões.
Por outro lado, a microbiologia é uma disciplina que explora o fascinante universo dos microrganismos; organismos que são invisíveis a olho nu, mas que têm um impacto profundo em nossas vidas. Neste campo, são estudados não apenas os patógenos que causam doenças, mas também os microrganismos benéficos que sustentam a vida, como bactérias que ajudam na digestão e produzem substâncias essenciais para a saúde humana.
A microbiologia requer uma compreensão profunda das interações entre os microrganismos e os seres humanos, bem como o meio ambiente. Esse conhecimento é crucial para desenvolver diagnósticos eficazes, vacinas e tratamentos, além de garantir a segurança alimentar e hídrica. A luta contra infecções cruza os caminhos da microbiologia e das análises clínicas: enquanto as análises clínicas fornecem as bases para o diagnóstico, a microbiologia fornece as ferramentas para entender e combater as infecções.
Ambas as disciplinas, quando combinadas, oferecem uma visão abrangente da saúde e da doença, permitindo que profissionais de saúde façam intervenções informadas e eficazes. Estudar Análises Clínicas e Microbiologia não é apenas sobre entender organismos e métodos, mas sobre cultivar a capacidade de impactar vidas e melhorar a saúde pública como um todo. É uma jornada de descoberta, que une ciência, medicina e a busca incessante por um futuro mais saudável.

Cultura e diagnóstico microbiano
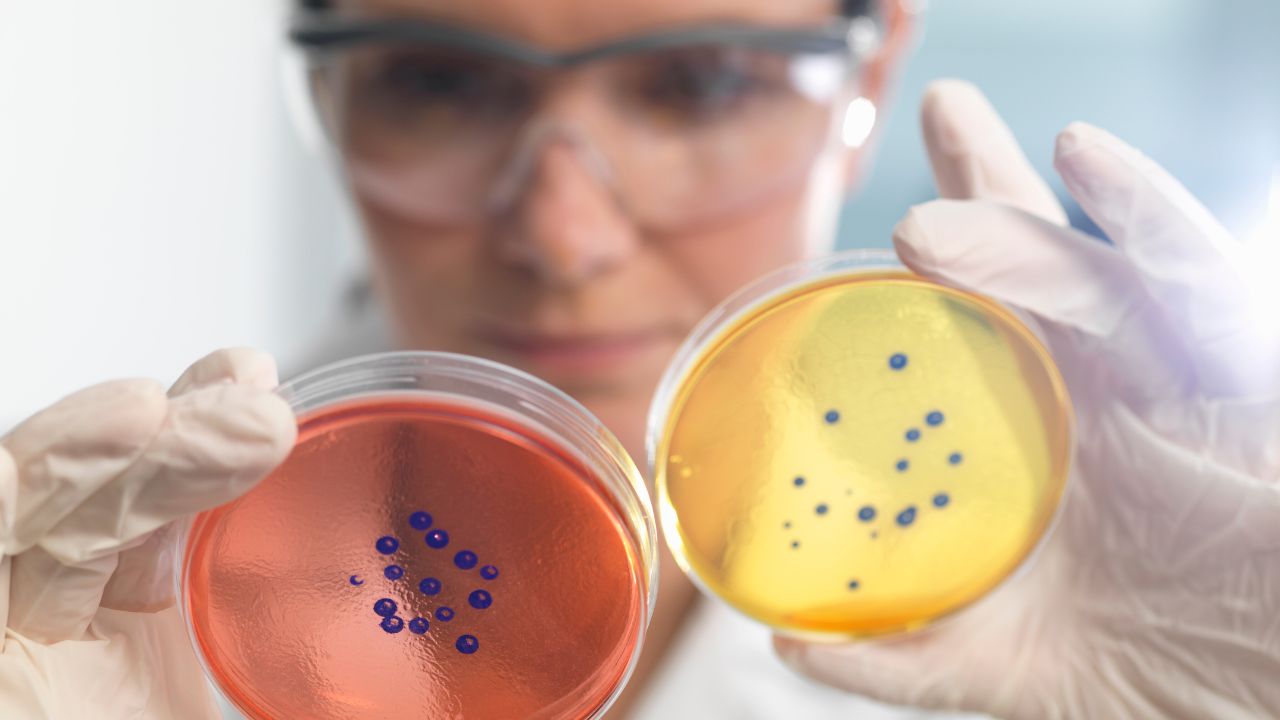
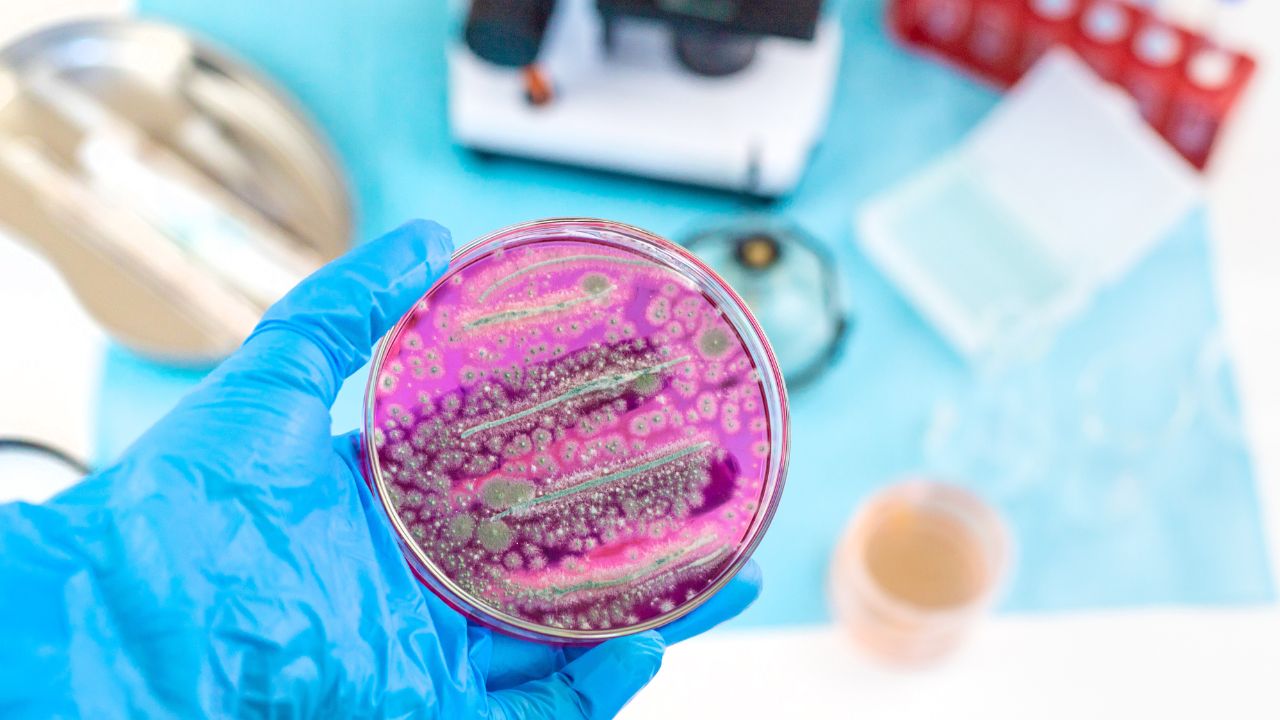
A cultura e o diagnóstico microbiano desempenham um papel crucial na medicina diagnóstica, sendo indispensáveis para a identificação precisa de infecções e doenças. Este campo científico demanda técnicas rigorosas para a coleta e cultivo de amostras biológicas, seja de fluidos corporais como sangue e urina, ou amostras coletadas de superfícies e ambientes contaminados. O rigor na metodologia garante que os microrganismos sejam isolados e identificados de forma eficaz, permitindo um diagnóstico rápido e preciso.
Um dos aspectos mais fascinantes desse processo é a variedade de meios de cultura disponíveis, cada um projetado para favorecer o crescimento de diferentes tipos de microrganismos. Por exemplo, o meio de cultura ágar MacConkey é amplamente utilizado para isolar bactérias Gram-negativas, especialmente aquelas que podem causar doenças gastrointestinais. Este meio não apenas facilita a identificação das bactérias, como também permite analisar a capacidade fermentativa das mesmas, gerando dados valiosos sobre suas características metabólicas.
Além de bactérias, o diagnóstico microbiano também se estende ao estudo de vírus, fungos e parasitas. A análise das características gerais dos vírus é particularmente intrigante, pois esses agentes patogênicos são conhecidos por sua complexidade e impacto na saúde humana. Os vírus podem provocar uma gama de doenças, desde resfriados comuns até infecções letais, como a COVID-19. Portanto, compreender como os vírus interagem com o sistema imunológico humano é essencial para a pesquisa e desenvolvimento de tratamentos eficazes e vacinas.
A integração entre a microbiologia e a cultura de microrganismos não é apenas uma questão técnica; é uma área de estudo que tem implicações diretas para a saúde pública. A capacidade de diagnosticar rapidamente infecções microbianas e entender suas características patológicas é vital para conter surtos, planejar intervenções de saúde pública e garantir a segurança da população.
Por meio do avanço na cultura e diagnóstico microbiano, médicos e cientistas têm à disposição as ferramentas necessárias para enfrentar os desafios atuais e futuros da saúde. A contínua pesquisa nessa área não apenas aprimora as técnicas existentes, mas também abre portas para descobrir novas abordagens que podem transformar a prática médica, salvando vidas e melhorando a saúde global. Assim, investir no conhecimento sobre cultura e diagnóstico microbiano representa um passo essencial para qualquer profissional da saúde que deseja fazer diferença em um mundo onde as doenças infecciosas continuam a ser um desafio constante.
Imunologia: conceitos, regulação e doenças
A imunologia é uma disciplina fascinante e complexa, que representa a linha de defesa do nosso organismo contra patógenos, como bactérias, vírus, fungos e parasitas. Compreender a imunologia é fundamental não apenas para profissionais da saúde, mas para todos que desejam entender melhor como o corpo humano se defende de ameaças externas. Essa área do conhecimento se entrelaça intimamente com as análises clínicas e a microbiologia, formando uma base sólida para o diagnóstico e tratamento de doenças.
No cerne da imunologia está o sistema imune, uma rede altamente sofisticada de células, tecidos e órgãos que trabalham em conjunto para identificar e eliminar invasores. Entre as principais células do sistema imune estão os linfócitos, que desempenham papéis fundamentais na resposta imunológica. Os linfócitos T ajudam a destruir células infectadas, enquanto os linfócitos B são responsáveis pela produção de anticorpos, que neutralizam patógenos e marcam-nos para destruição. Essa resposta imune adaptativa é vital para prevenir infecções e desenvolver memória imunológica, que permite ao organismo responder de maneira mais eficaz a futuras exposições ao mesmo patógeno.
A imunologia também explora a regulação do sistema imunológico, que é crucial para a manutenção da homeostase. O equilíbrio adequado entre a resposta imunológica e a tolerância é essencial. Quando esse equilíbrio é rompido, podem surgir doenças autoimunes, onde o sistema imune ataca células saudáveis do próprio corpo. Exemplos incluem condições como lúpus, artrite reumatoide e esclerose múltipla, que podem resultar em inflamação crônica e danos a tecidos.
Outro aspecto importante da imunologia é a resposta a alergias, que ocorrem quando o sistema imunológico reage de forma exagerada a substâncias geralmente inofensivas, como pólen, alimentos ou fármacos. Essa hipersensibilidade pode provocar sintomas que variam de leves a graves, como rinite alérgica, urticária e anafilaxia. A compreensão das respostas alérgicas e dos mecanismos subjacentes é vital para desenvolver tratamentos eficazes e estratégias de prevenção.
Fascinantemente, fatores externos como dieta, estresse e exposição a toxinas ambientais podem impactar significativamente a eficácia do sistema imunológico. Por exemplo, uma dieta equilibrada, rica em nutrientes essenciais, pode reforçar as defesas do corpo, enquanto hábitos alimentares inadequados e estresse crônico podem levar a uma imunidade comprometida. A análise criteriosa desses fatores sanitários é vital para manter a saúde em dia e prevenir doenças.
Investir na compreensão da imunologia é, portanto, uma jornada que transcende o conhecimento teórico. Ela fornece as ferramentas necessárias para fomentar a saúde, prevenir doenças e inovar na terapêutica. Ao aprofundar-se nesse campo, você não apenas amplia seu repertório profissional, mas também se torna um agente ativo na promoção da saúde pública e no enfrentamento dos desafios atuais e futuros da medicina. Essa compreensão crítica, aliada à prática, pode fazer uma diferença significativa na vida das pessoas e na saúde da sociedade como um todo.
Imunologia: renal, respiratória, gástrica, ocular e transplantes
A imunologia não se limita à compreensão básica do sistema imunológico, mas se expande por diversas especializações que são cruciais para o tratamento de doenças específicas. Ao explorar as áreas de imunologia renal, respiratória, gástrica e ocular, bem como o complexo campo dos transplantes, podemos observar como o sistema imunológico atua em contextos variados e como suas respostas podem impactar a saúde do paciente de maneiras profundas e às vezes devastadoras.
No contexto da imunologia renal, a glomerulonefrite se destaca como uma condição emblemática. Essa doença implica numa inflamação dos glomérulos—estruturas das nefronas nos rins que filtram o sangue. Quando o sistema imunológico ataca erroneamente essas estruturas, podem ocorrer lesões que prejudicam a filtração, resultando em complicações severas como insuficiência renal. Diagnósticos precisos são essenciais neste cenário, pois permitem que médicos implementem estratégias de tratamento adequadas, que podem incluir desde terapias imunossupressoras até intervenções mais complexas, como diálise.
A imunologia respiratória, por sua vez, está profundamente relacionada a condições como asma e doenças autoimunes que afetam o trato respiratório. Nesses casos, o sistema imunológico pode reagir hipersensivelmente a alérgenos ou patógenos, resultando em inflamação crônica e dificultando a respiração. O entendimento das respostas imunológicas nestes contextos é vital para o desenvolvimento de terapias que não apenas tratem os sintomas, mas que também modifiquem a resposta do sistema imunológico e ofereçam uma melhora na qualidade de vida dos pacientes.
A imunologia gástrica se debruça sobre problemas como gastrite autoimune e doenças inflamatórias intestinais, onde o sistema imunológico ataca os tecidos do trato gastrointestinal. O impacto de tais condições pode ser devastador. Fatores como a dieta e o ambiente também desempenham papéis cruciais na suscetibilidade a essas doenças, tornando a pesquisa nessa área vital para a promoção da saúde gastrointestinal.
A imunologia ocular, embora menos discutida, é igualmente importante. Doenças como a uveíte, que envolve a inflamação da úvea (camada do olho) podem ser desencadeadas por respostas autoimunes. A preservação da visão está intimamente ligada ao entendimento da resposta imunológica nessa região, e a intervenção precoce pode evitar danos severos.
O campo dos transplantes requer um conhecimento da imunologia que é crucial para garantir a compatibilidade entre doadores e receptores. Quando um órgão é transplantado, o sistema imunológico do receptor pode reconhecer o órgão como um corpo estranho e tentar rejeitá-lo. A compatibilidade genética e a compreensão dos marcadores de histocompatibilidade, que ajudam a prever como o sistema imunológico reagirá, são fundamentais para o sucesso dos transplantes. Isso eleva o nível da ciência médica, unindo a imunologia à engenharia genética e à biotecnologia, em uma busca contínua por melhores resultados.
A interconexão entre as várias áreas da imunologia demonstra a complexidade do corpo humano e a importância de uma abordagem integrada na medicina. Aumentar o nosso entendimento sobre como o sistema imunológico opera em diferentes contextos não só prepara os profissionais da saúde para enfrentar os desafios do presente, mas também abre portas para inovações no tratamento e manejo de doenças. Esse conhecimento, aplicado com sabedoria, é um caminho promissor rumo a um futuro mais saudável, no qual as possibilidades de intervenções médicas se ampliam incessantemente.
Hematopoese e as Fases do Hemograma
A hematopoese é um processo fisiológico crucial no organismo humano, responsável pela formação de todas as células sanguíneas, incluindo glóbulos vermelhos, glóbulos brancos e plaquetas. Essa dinâmica ocorre principalmente na medula óssea e é vital para a manutenção da homeostase. A capacidade do corpo de produzir células sanguíneas de forma eficiente e contínua é essencial para diversas funções, como o transporte de oxigênio, a resposta imunológica e a coagulação sanguínea.
A análise do hemograma é uma ferramenta clínica indispensável e oferece uma visão aprofundada da saúde do paciente. Este exame vai além de simplesmente contar as células sanguíneas; ele fornece dados relevantes sobre suas características, como o volume corpuscular médio, a concentração de hemoglobina e as diferentes subpopulações de glóbulos brancos. Essas informações são cruciais para detectar condições como anemia, leucemias, infecções e outras desordens hematológicas.
Entretanto, o sucesso na interpretação do hemograma está intimamente ligado à precisão em todas as fases do processo de análise. As etapas pré-analíticas, analíticas e pós-analíticas são interdependentes e a ocorrência de erros em qualquer uma delas pode comprometer os resultados do exame.
Na fase pré-analítica, fatores como a coleta inadequada da amostra, armazenamento incorreto ou identificação errônea podem levar a resultados enganosos. Um exemplo comum é a coleta de sangue em tubos inadequados, o que pode resultar na hemólise das células e, consequentemente, em um hemograma alterado.
Já na fase analítica, o uso de equipamentos calibrados e a aplicação de técnicas apropriadas são essenciais. Erros na utilização de dispositivos automatizados, contaminação de amostras ou falhas técnicas podem gerar dados imprecisos. Portanto, é vital que os profissionais de saúde sejam treinados e atualizados sobre as melhores práticas e tecnologias disponíveis.
Por último, a fase pós-analítica envolve a interpretação dos resultados e a comunicação dessas informações ao clínico responsável. Aqui, a análise deve ser contextualizada com o quadro clínico do paciente, levando em consideração fatores como histórico médico e sintomas apresentados. Um laudo mal interpretado pode resultar em diagnósticos errôneos e, por consequência, em tratamentos inadequados.
Diante disso, a implementação de um controle de qualidade rigoroso ao longo de todas as etapas é fundamental para assegurar a confiabilidade do hemograma. Protocolos claros, uso de controles internos e externos, assim como treinamentos regulares da equipe, são imprescindíveis para minimizar erros e garantir que os resultados sejam fidedignos. Ao conseguir resultados precisos e confiáveis, os profissionais de saúde podem tomar decisões clínicas mais informadas, otimizando o tratamento e a saúde dos pacientes.
A hematopoese e as fases do hemograma, portanto, não são meros componentes isolados; eles formam um sistema complexo e interligado que é essencial para a compreensão da saúde e da doença. Investir no domínio desses conceitos é um ato de responsabilidade, que não só promove a excelência na prática médica, mas também redefine o padrão de cuidado aos pacientes, onde cada hemograma é uma nova oportunidade para melhorar vidas.
Análise do eritrograma laboratorial e a anemia
A anemia é uma condição de saúde amplamente prevalente que afeta milhões de indivíduos em todo o mundo, influenciando negativamente a qualidade de vida e, em casos severos, podendo ser fatal. Essa afeição é caracterizada pela diminuição da capacidade do sangue de transportar oxigênio, geralmente devido a uma redução no número de eritrócitos (glóbulos vermelhos) ou na concentração de hemoglobina. Dessa forma, a análise do eritrograma laboratorial torna-se uma ferramenta primordial para classificar e entender as diversas causas dessa condição.
O eritrograma não apenas quantifica os eritrócitos, mas também fornece dados cruciais sobre a morfologia das células sanguíneas e índices eritrocitários, como o hematócrito e a concentração de hemoglobina. A interpretação desses índices é fundamental para identificar se a anemia é microcítica, macrocítica ou normocítica, cada uma das quais possui implicações diferentes em termos de diagnóstico e tratamento. Por exemplo, anemias microcíticas geralmente resultam de deficiências nutricionais, como a falta de ferro, enquanto anemias macrocíticas podem estar associadas a deficiências de vitamina B12 ou ácido fólico.
A falta de ferro é a causa mais comum de anemia em muitas populações e pode levar a complicações sérias se não for tratada adequadamente. Os sintomas incluem fadiga, fraqueza, palidez e dificuldade de concentração, que podem afetar de forma significativa o desempenho físico e cognitivo. A análise criteriosa do eritrograma pode revelar padrões que ajudam a determinar se a anemia é ferropriva, possibilitando intervenções precoces.
Além da contagem de eritrócitos, a função da hemoglobina é um aspecto crítico a ser considerado. A hemoglobina, proteína responsável pelo transporte de oxigênio, desempenha um papel vital no fornecimento de energia para os tecidos corporais. Uma redução nos níveis de hemoglobina pode não apenas indicar anemia, mas também refletir a gravidade da condição e a necessidade de tratamento, que pode incluir suplementação de ferro, transfusões de sangue ou, em alguns casos, terapias mais complexas.
É igualmente importante realizar uma avaliação abrangente do quadro clínico do paciente. Dados históricos, incluindo dietas, condições de saúde preexistentes e sintomas, devem ser considerados em conjunto com os resultados do eritrograma. Essa visão holística permite que os profissionais de saúde identifiquem corretamente a causa subjacente da anemia e definam o plano de tratamento mais apropriado.
Em suma, a análise do eritrograma laboratorial e a compreensão das nuances da anemia não são apenas aspectos técnicos, mas sim componentes essenciais da prática clínica que impactam diretamente a saúde e o bem-estar dos pacientes. Ao promover uma análise meticulosa e contextualizada, profissionais de saúde têm a capacidade de transformar a vida daqueles que sofrem de anemia, oferecendo intervenções que não apenas tratam os sintomas, mas também abordam as causas fundamentais. Essa abordagem integrada pode levar a melhores resultados em saúde e à promoção de um estilo de vida mais saudável.
Análise do leucograma e a leucemia
Os leucócitos, também conhecidos como glóbulos brancos, desempenham um papel crítico na defesa do organismo contra infecções e outras doenças. A análise do leucograma, que quantifica e caracteriza as diferentes subpopulações de leucócitos presentes no sangue, é uma ferramenta indispensável para os profissionais de saúde na avaliação do estado imunológico do paciente. Este exame não só auxilia no diagnóstico de leucemias e outras condições inflamatórias, mas também fornece um panorama abrangente sobre a saúde geral do indivíduo.
A interpretação detalhada do leucograma permite identificar alterações nas séries leucocitárias que podem indicar a presença de doenças graves. Por exemplo, um aumento significativo no número de leucócitos pode sugerir uma infecção aguda ou uma resposta inflamatória, enquanto uma contagem baixa pode sinalizar problemas na medula óssea, que é responsável pela produção dessas células. Em particular, a detecção precoce de alterações na contagem e na morfologia dos leucócitos pode ser fundamental na luta contra leucemias, tipos de câncer que afetam as células sanguíneas e acometem diversas faixas etárias.
Leucemias são classificadas em agudas e crônicas, variando em suas características e prognósticos. A leucemia aguda, por exemplo, pode se desenvolver rapidamente e apresenta uma quantidade anormal de células imaturas, conhecidas como “blastos”, no sangue. Essas células anormais não desempenham funções adequadas, prejudicando drasticamente a capacidade do organismo de combater infecções e realizar outras funções essenciais. Por outro lado, a leucemia crônica é caracterizada pelo acúmulo de células maduras anormais, que podem ser mais sutis em sua apresentação clínica, porém igualmente perigosas.
O impacto das leucemias na vida dos pacientes é profundo e pode alterar não apenas a saúde física, mas também o bem-estar emocional e psicológico. Um diagnóstico precoce é crucial; identificar a condição em seus estágios iniciais aumenta significativamente as chances de sucesso nos tratamentos. Terapias como quimioterapia, radioterapia e transplante de medula óssea têm se mostrado eficazes, mas sua eficácia está intimamente ligada à rapidez com que a leucemia é reconhecida e tratada.
Dado o contexto, a análise do leucograma não deve ser subestimada. Ela é uma porta de entrada para intervenções rápidas e eficazes que podem salvar vidas. A antecipação na detecção de anomalias não permite apenas uma abordagem reativa, mas também pode facilitar estratégias preventivas, contribuindo para um melhor manejo das doenças hematológicas.
Em suma, a análise do leucograma é um componente essencial na avaliação da saúde do paciente e na detecção de condições críticas, como a leucemia. Profissionais de saúde equipados com um entendimento profundo das implicações desse exame são capazes de agir de maneira proativa, melhorando os prognósticos e a qualidade de vida dos pacientes. Com um olhar atento e uma interpretação acurada dos resultados, é possível transformar a luta contra a leucemia em uma história de esperança e recuperação.
Análise das plaquetas e as neoplasias
As plaquetas, ou trombócitos, são células fundamentais no processo de coagulação sanguínea. Elas desempenham um papel vital na manutenção da hemostasia, formando crostas em locais de lesão vascular e colaborando para evitar a perda excessiva de sangue. No entanto, a contagem e a função das plaquetas podem ser alteradas por uma série de condições patológicas, incluindo diversas neoplasias hematológicas. Entender a dinâmica das plaquetas é, portanto, essencial para o diagnóstico e manejo de distúrbios hemostáticos e cânceres que afetam o sistema hematopoiético.
Alterações nas contagens de plaquetas podem indicar uma gama de condições. Plaquetas elevadas, conhecidas como trombocitose, podem ocorrer em resposta a uma infecção, inflamação ou até mesmo em processos neoplásicos, como leucemias ou mieloproliferativas. Por outro lado, a trombocitopenia, caracterizada pela diminuição das plaquetas, pode resultar de um aumento na destruição das plaquetas, problemas na produção na medula óssea, ou condições sistêmicas, como o uso de certos medicamentos ou a presença de doenças autoimunes.
As neoplasias hematológicas, que incluem leucemias, linfomas e síndromes mielodisplásicas, muitas vezes interferem na produção e na função das plaquetas, levando a alterações significativas em sua contagem e na resposta a lesões. O entendimento dessas relações torna-se crítico, pois as plaquetas não apenas são um marcador do estado da saúde do paciente, mas também desempenham um papel ativo na progressão da doença. Por exemplo, em alguns tipos de câncer, as plaquetas podem ser utilizadas pelos tumores para criar um ambiente propício à sua sobrevivência e metastização.
A análise das plaquetas, portanto, vai além de uma simples contagem. Inclui a interpretação de características adicionais, como a morfologia das plaquetas e os resultados do plaquetograma e coagulograma. Essas análises ajudam a diferenciar entre causas reativas e patológicas das alterações nas plaquetas, permitindo um diagnóstico mais preciso e uma abordagem terapêutica adequada.
O impacto das neoplasias hematológicas na saúde do paciente é significante e pode variar consideravelmente. Para cada tipo de neoplasia, o tratamento pode incluir quimioterapia, radioterapia ou transplante de medula óssea, e a gestão das plaquetas torna-se crucial durante todo o processo. Com níveis de plaquetas reduzidos, os pacientes correm um risco aumentado de hemorragias, enquanto níveis elevados podem contribuir para a formação de coágulos, levando a complicações sérias.
A análise e o monitoramento das plaquetas são, portanto, componentes essenciais no cuidado com pacientes que enfrentam neoplasias hematológicas. Profissionais de saúde que compreendem profundamente a importância das plaquetas e suas implicações podem garantir intervenções mais eficazes e personalizadas, promovendo uma abordagem mais holística para o cuidado do paciente e, consequentemente, melhores resultados na saúde.
Em resumo, a análise das plaquetas é uma ferramenta crítica na identificação de condições clínicas que vão muito além da coagulação sanguínea. Ela serve como um indicador vital da saúde hematológica e como um marcador das interações complexas entre a coagulação e as doenças neoplásicas. Ao aprofundar a compreensão sobre esses elementos, os profissionais da saúde podem proporcionar um cuidado mais abrangente e eficaz, auxiliando na luta contra as neoplasias hematológicas e suas complicações.

Urinálise
A urinálise é um exame simples e eficaz que fornece um panorama detalhado do estado de saúde de um paciente, desempenhando um papel crucial na medicina diagnóstica. Por meio da análise da urina, é possível identificar uma variedade de condições médicas, que vão desde infecções do trato urinário até doenças renais, problemas metabólicos e distúrbios sistêmicos.
Uma das principais vantagens da urinálise é sua natureza não invasiva e a facilidade de coleta, tornando-a uma ferramenta prática e acessível para profissionais de saúde. De fato, o exame de urina é amplamente utilizado para triagens e diagnósticos iniciais devido ao seu baixo custo e à rapidez dos resultados. Além disso, a análise pode ser realizada em diferentes configurações, desde consultórios médicos até grandes laboratórios, ampliando sua aplicabilidade no cuidado ao paciente.
No contexto clínico, a urinálise é bastante utilizada para detectar infecções do trato urinário (ITU), que são uma das condições mais comuns. Os sintomas de ITUs podem incluir dor ao urinar, urgência frequente e desconforto abdominal. A urina pode apresentar alterações, como presença de leucócitos, nitritos e hemoglobina, que são indicadores-chave na identificação de infecções. O diagnóstico precoce dessas condições é fundamental, pois infecções não tratadas podem levar a complicações sérias, como pielonefrite—uma infecção renal grave.
Além das infecções, a urinálise é essencial na avaliação da função renal. Por meio da detecção de proteínas, glicose e a presença de cilindros urinários, é possível identificar enfermidades como a síndrome nefrótica e a glomerulonefrite. A presença de albumina, por exemplo, pode ser um sinal precoce de dano renal, e seu monitoramento é crucial para pacientes com diabetes ou hipertensão, condições que sobrecarregam os rins.
Outro aspecto relevante da urinálise é que o exame pode revelar informações sobre o estado metabólico do paciente. A avaliação de substâncias como certos cristais, cetonas e pH da urina pode ajudar a identificar distúrbios metabólicos, como acidose ou alcalose, e condições como diabetes mellitus, onde a presença de corpos cetônicos pode indicar cetoacidose.
É importante ressaltar que, embora a urinálise forneça informações valiosas, a interpretação dos resultados deve ser sempre contextualizada com a história clínica do paciente e outros exames complementares. O exame pode, por vezes, gerar resultados falso-positivos ou falso-negativos, que devem ser verificados por meio de investigações adicionais quando necessário.
Em suma, a urinálise se firmou como uma ferramenta indispensável na prática clínica contemporânea, oferecendo uma janela significativa para a saúde do paciente. O potencial diagnóstico da urinálise, aliado à sua acessibilidade, faz dela um exame fundamental para a identificação precoce de patologias e para o monitoramento contínuo das condições de saúde. Profissionais que dominam a interpretação e aplicação correta deste exame são capacitados a proporcionar cuidados mais eficazes, assegurando que os pacientes recebam a atenção necessária e adequada para suas necessidades de saúde.
Patologias urinárias e renais
As doenças renais representam uma séria preocupação de saúde pública, afetando milhões de pessoas em todo o mundo e gerando um impacto significativo na qualidade de vida dos pacientes. Por sua natureza progressiva e frequentemente assintomática em estágios iniciais, a compreensão das patologias urinárias e renais é fundamental para a identificação precoce e a implementação de estratégias de tratamento eficazes.
As patologias renais podem variar de infecções do trato urinário (ITU) a condições mais complexas como a glomerulonefrite e as síndromes nefríticas. A glomerulonefrite é caracterizada pela inflamação dos glomérulos, as unidades de filtração do rim, o que pode comprometer significativamente a função renal. Esta condição pode ser causada por infecções, doenças autoimunes ou mesmo reações a medicamentos. O reconhecimento precoce da glomerulonefrite é vital, pois uma intervenção médica precoce pode prevenir a progressão para insuficiência renal crônica, que requer terapia de diálise ou transplante.
As síndromes nefríticas, que incluem a glomerulonefrite, apresentam sintomas como hematuria (sangue na urina), proteinúria (proteínas na urina), hipertensão e inchaço. Identificar esses sinais clínicos é crucial para um diagnóstico adequado e para a formulação de um plano de tratamento que aborde tanto os sintomas quanto a causa subjacente da condição. Isso pode envolver a administração de medicamentos imunossupressores, antihipertensivos e, em alguns casos, terapia de diálise.
Além de condições inflamatórias, outras patologias renais podem incluir doenças císticas, como a doença renal policística, que é caracterizada pela formação de cistos nos rins e pode levar a uma progressiva perda da função renal. A identificação de cistos pode ser feita através de exames de imagem e requer acompanhamento regular para monitorar a evolução da doença.
Infecções do trato urinário (ITU) são outra preocupação significativa. Embora muitas vezes tratáveis, ITUs recorrentes podem ser sintoma de condições subjacentes mais graves, como obstruções ou malformações anatômicas. Utilizando urinálise, médicos podem rapidamente diagnosticar essas infecções e iniciar o tratamento, minimizando potenciais complicações, como a progressão para pielonefrite, uma infecção renal grave.
A educação do paciente sobre sintomas e sinais de alerta é uma parte essencial da estratégia de prevenção e manejo das patologias urinárias e renais. Pacientes informados são mais propensos a buscar atendimento médico precocemente, o que, por sua vez, se traduz em melhores prognósticos e menor risco de desenvolvimento de complicações associadas.
Em suma, a compreensão das patologias urinárias e renais e suas implicações é um fator determinante na eficácia das intervenções clínicas. O reconhecimento precoce de condições como a glomerulonefrite e as síndromes nefríticas, aliado a uma abordagem proativa de manejo e tratamento, pode não apenas melhorar a qualidade de vida dos pacientes, mas também transformar desfechos de saúde, evitando a progressão de doenças e promovendo uma saúde renal duradoura. Profissionais de saúde comprometidos em capacitar-se com conhecimento atual sobre essas condições estão melhor equipados para enfrentar os desafios apresentados pelas doenças renais e para proporcionar um cuidado de qualidade a seus pacientes.
Pós-graduação em Análises Clínicas e Microbiologia
A pós-graduação em Análises Clínicas e Microbiologia é uma oportunidade valiosa para profissionais da saúde que buscam aprimorar seus conhecimentos e habilidades em um campo em constante evolução. Este programa é projetado para fornecer uma compreensão aprofundada das técnicas laboratoriais, microbiológicas e imunológicas que são cruciais para a prática clínica moderna.
Durante o curso, os alunos têm a oportunidade de explorar temas essenciais como a cultura e o diagnóstico microbiano, que envolvem a identificação precisa de infecções e doenças. O domínio de métodos laboratoriais para a coleta e análise de amostras biológicas é fundamental para garantir diagnósticos corretos, que impactam diretamente o tratamento e a saúde dos pacientes.
Além disso, a pós-graduação aborda questões relacionadas à imunologia, capacitando os profissionais a compreenderem as complexas interações do sistema imune com as doenças. A inclusão de temas como a resposta imunológica a alergias e doenças autoimunes permite que os alunos desenvolvam uma abordagem crítica e integrada ao cuidado do paciente.
Um dos principais focos do programa é a análise do hemograma e das plaquetas, vitais para diagnosticar hematopatias e outras condições clínicas. O currículo oferece formação teórica e prática, abordando desde a hematopoese até a interpretação dos resultados laboratoriais, propiciando uma base sólida para a atuação em ambientes de laboratório.
Os alunos também têm oportunidade de estudar patologias urinárias e renais, fundamental para entender como as condições do trato urinário afetam a saúde geral e como diagnósticos precoces podem melhorar os resultados clínicos. Com a formação em urinálise, os profissionais ficam mais bem equipados para detectar e tratar infecções, disfunções renais e outras patologias relacionadas.
Ao final da pós-graduação, os profissionais não apenas se tornam especialistas em Análises Clínicas e Microbiologia, mas também ganham a confiança necessária para conduzir pesquisas e desenvolver práticas inovadoras que contribuam para a melhoria contínua da saúde pública.
Participar de uma pós-graduação nessa área é, portanto, um passo significativo para quem deseja se destacar no mercado de trabalho e fazer a diferença na vida dos pacientes. O curso não apenas oferece conhecimentos essenciais, mas também promove uma visão integrada da saúde, fortalecendo a capacidade dos profissionais de lidar com os desafios emergentes na área de saúde e laboratorio. Ao investir na educação continuada, os profissionais da saúde asseguram não apenas seu crescimento pessoal, mas também o avanço da qualidade dos serviços prestados à população.

Por que apostar nas Análises Clínicas e Microbiologia?
Num cenário em constante evolução, as análises clínicas e microbiologia se reafirmam como campos dinâmicos e indispensáveis na área da saúde.
Você pode se tornar um participante ativamente envolvido na melhoria da saúde da população, utilizando conhecimentos técnicos para impactar vidas diretamente. Ao explorar estas áreas, você não apenas expande seu conhecimento, mas também contribui para um mundo mais saudável e informado.
Se você está pronto para desvendar o intrigante mundo das análises clínicas e microbiologia, saiba que há muitas oportunidades aguardando. Aprofundar-se nesses campos não apenas proporcionará um futuro profissional promissor, mas também será sua chance de fazer a diferença na vida de muitos.
Prepare-se para se aventurar em um espaço onde a ciência e a medicina se encontram, e você possui o poder de contribuir com a saúde pública e a pesquisa. O caminho é desafiador, mas a recompensa é inestimável.
Agora que você mergulhou nas análises clínicas e microbiologia, que passos você dará em direção a um futuro brilhante nesta área promissora? Não espere mais para transformar seu interesse em ação e investir no seu futuro!
Perguntas Frequentes sobre Análises Clínicas e Microbiologia
Qual é a principal função da microbiologia em análises clínicas?
A microbiologia em análises clínicas é fundamental para identificar e caracterizar microrganismos patogênicos em amostras biológicas. Isso inclui a detecção de bactérias, vírus, fungos e parasitas que causam infecções. O diagnóstico precoce e preciso dessas infecções é essencial para o tratamento adequado dos pacientes.
O que estuda Microbiologia Clínica?
A Microbiologia Clínica estuda os microrganismos que causam doenças em humanos. Isso inclui a identificação de patógenos, suas características, métodos de transmissão, resistência aos antimicrobianos e as melhores práticas para seu controle e tratamento.
O que se faz em um laboratório de microbiologia?
Em um laboratório de microbiologia, os profissionais realizam testes para isolar e identificar microrganismos de amostras variadas, como sangue, urina, fezes e secreções. Os laboratórios também conduzem testes de sensibilidades a antibióticos, monitoram surtos de doenças e atuam na pesquisa de novos patógenos.
O que se estuda em análises clínicas?
O curso de análises clínicas abrange a coleta, análise e interpretação de diversas amostras biológicas, incluindo sangue, urina e fezes. Os alunos estudam técnicas laboratoriais, bioquímica clínica, hematologia, microbiologia, imunologia, entre outras áreas, que são essenciais para o diagnóstico e acompanhamento de doenças.
Qual o salário de um técnico de análises clínicas?
O salário de um técnico de análises clínicas pode variar conforme a região e a experiência, mas, em média, gira em torno de R$ 2.500 a R$ 4.000. Em grandes cidades ou em instituições de saúde mais renomadas, este valor pode ser maior.
Quem faz análises clínicas pode trabalhar onde?
Os profissionais formados em análises clínicas podem trabalhar em laboratórios de análises clínicas, hospitais, clínicas de saúde, laboratórios de pesquisa, indústrias farmacêuticas, e também podem atuar na área de controle de qualidade de produtos e processos relacionados à saúde.
O curso de análises clínicas vale a pena?
Sim, o curso de análises clínicas vale a pena para quem tem interesse em saúde e biologia. Esta área de atuação é promissora, com uma demanda consistente por profissionais qualificados, possibilitando um impacto significativo na vida das pessoas.
Qual curso técnico ganha mais?
No Brasil, os cursos técnicos na área da saúde, como enfermagem e análises clínicas, costumam ter bons salários. Entretanto, áreas como radiologia e farmácia têm se destacado, em algumas regiões, como as que oferecem um melhor retorno financeiro.
Onde atuam as análises clínicas?
Profissionais de análises clínicas atuam em laboratórios de análises, hospitais, clínicas ambulatoriais, indústrias farmacêuticas, serviços públicos de saúde e instituições de pesquisa, entre outros locais.
Quantas horas por dia trabalha um técnico de análises clínicas?
A carga horária de um técnico de análises clínicas varia, mas geralmente é de 40 horas semanais, podendo incluir turnos de 8 horas por dia. Alguns profissionais trabalham em turnos alternados ou incluem plantões.
Quais são as áreas de análises clínicas?
As áreas de análises clínicas incluem hematologia, imunologia, bioquímica clínica, microbiologia, parasitologia, citologia, urinálise e análise de fezes, cada uma focando em diferentes aspectos da saúde e doenças.
Qual é o nome do profissional que coleta sangue?
O profissional que coletam sangue é chamado de “técnico de coleta” ou “técnico de enfermagem”. Alguns formados especificamente em coleta de sangue são conhecidos como “flebotomistas“.
Qual é o nome da profissão que coleta sangue?
A profissão que coleta sangue é normalmente referida como flebotomista, embora os técnicos de enfermagem e técnicos de análises clínicas também realizem essa função.
Qual é o nome da profissão que analisa fezes?
O profissional que analisa fezes é conhecido como analista ou técnico de análises clínicas, e pode atuar especificamente em laboratórios de parasitologia ou microbiologia.
Qual curso devo fazer para trabalhar com coleta de sangue?
Para trabalhar com coleta de sangue, esses profissionais podem se formar em cursos técnicos de análises clínicas ou enfermagem, onde aprendem técnicas e práticas de coleta venosa e capilar.
Quais são as matérias do curso de análises clínicas?
As matérias do curso de análises clínicas incluem Bioquímica, Microbiologia, Hematologia, Imunologia, Parasitologia, Ética e Legislação em Saúde, Coleta e Análises de Amostras, entre outras.
Quanto tempo dura um curso de coleta de sangue?
O curso técnico voltado especificamente para coleta de sangue (Flebotomia) pode ter duração de 6 meses a 1 ano, dependendo da instituição e do currículo.
Qual o melhor curso para trabalhar em laboratório?
O curso de Análises Clínicas é um dos melhores para quem deseja trabalhar em laboratório, pois abrange diversas áreas de atuação e fornece um conhecimento abrangente sobre técnicas e análises laboratoriais.
Onde posso trabalhar com um curso de análises clínicas?
Com um curso de análises clínicas, você pode trabalhar em laboratórios de análises clínicas, hospitais, clínicas de saúde, serviços públicos, pesquisa acadêmica, indústrias farmacêuticas, entre outros lugares.
Qual o curso técnico mais bem pago?
Os cursos técnicos mais bem pagos incluem áreas como enfermagem, radiologia, farmácia e análises clínicas, especialmente em regiões metropolitanas com alta demanda por profissionais de saúde.
Como posso me tornar um analista de sangue?
Para se tornar um analista de sangue, é necessário completar um curso técnico em Análises Clínicas ou um curso de Flebotomia, onde aprenderá as técnicas de coleta e análise de amostras.
Como se chama o profissional que faz análises clínicas?
O profissional que faz análises clínicas é conhecido como “analista de análises clínicas” ou “técnico em análises clínicas”, dependendo da formação e das atribuições.
Como se especializar em coleta de sangue?
Para se especializar em coleta de sangue, é recomendável que o profissional realize um curso técnico em Flebotomia, que ensina as práticas e técnicas específicas para a coleta de sangue de forma segura e eficaz.
Como tirar o registro de técnico em análises clínicas?
Para tirar o registro de técnico em análises clínicas, o profissional deve se formar em um curso reconhecido, cumprir com a carga horária exigida e, em seguida, solicitar o registro no Conselho Regional de Biomédicos ou no Conselho Regional de Farmácia da sua região, seguindo as orientações específicas de cada conselho.